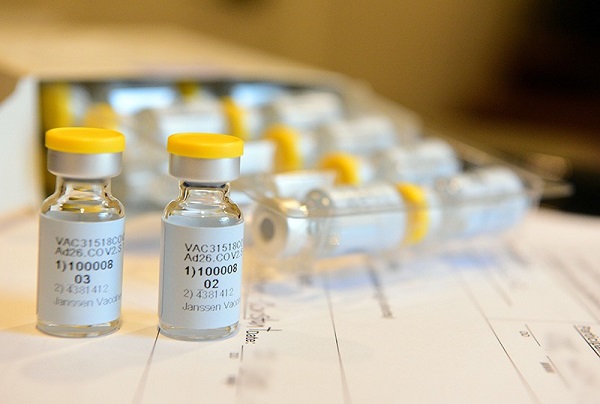
La FDA emite autorización de emergencia para la vacuna de Johnson & Johnson contra el SARS-CoV-2
De una sola dosis
maquina-de-combate.com – La Food and Drug Administration (FDA, Administración de Alimentos y Medicinas) ha emitido hoy 27 de febrero una autorización de uso de emergencia para la vacuna contra el SARS-CoV-2 que ha desarrollado Janssen Biotech, subsidiaria de Johnson & Johnson en Países Bajos.
El nuevo coronavirus SARS-CoV-2 genera la enfermedad respiratoria conocida como Covid-19.
La autorización de emergencia permite que la vacuna de Janssen Biotech sea distribuida en Estados Unidos para su uso en personas de 18 año o más. La FDA ha considerado que la vacuna cumple con los criterios para la emisión de la autorización extraordinaria. Los datos disponibles brindan evidencia clara que la vacuna puede ser efectiva en la prevención del Covid-19.
La vacuna de Johnson & Johnson, desarrollada por su subsidiaria Janssen Biotech, es manufacturado usando un tipo específico de un virus denominado Adenovirus Tipo 26 (Ad26). La vacuna usa el Ad26 para suministrar un pedazo de ADN (material genético) que se emplea para hacer la distintiva proteína pico del virus SARS-CoV-2.
Los Adenovirus son un grupo de virus relativamente común que genera síntomas de resfrío y conjuntivitis (ojo rosado). Para los efectos de la vacuna se ha modificado para que no se pueda reproducir en el organismo humano y no cause enfermedad. Luego de que la persona reciba la vacuna, su cuerpo producirá temporalmente la proteína pico, sin causar enfermedad, pero gatilla la respuesta defensiva del sistema inmunológico contra el SARS-CoV-2.
La vacuna de Johnson & Johnson se administra en una única dosis.
Datos de seguridad
La data de seguridad analizada incluye el análisis de 43 783 voluntarios en un estudio aleatorio, controlado con placebo que se viene desarrollando en Sudáfrica y algunos países de América del Sur, México y Estados Unidos.
21 895 voluntarios recibieron la vacuna y 21 888 recibieron un placebo salino. En el estudio se les hace seguimiento por un período promedio de ocho semanas tras la administración de la dosis única (una sola dosis). Los efectos secundarios más reportados fueron dolor en el lugar de la inyección, dolor de cabeza, fatiga, dolores musculares y nauseas. La mayoría de efectos secundarios fueron ligeros o moderados, durando entre uno a dos días.
Como parte de la autorización de uso de emergencia, Janssen Biotech Inc. y aquellas entidades que administren la vacuna, tendrán que seguir reportando al Sistema de Reporte de Eventos Adversos por la Vacuna (VAERS) sobre casos en que se hayan desarrollado efectos adversos severos y aquellos que hayan derivado en la hospitalización de las personas o en su subsecuente muerte. También se deben reportar errores en los procesos de vacunación.
Datos de efectividad
La data de efectividad que ha apoyado la emisión de la autorización de uso de emergencia incluye el análisis de 39 321 voluntarios en el estudio aleatorio, controlado por placebo, que se desarrolla en Sudáfrica, algunos países de América del Sur, México y Estados Unidos que no tenían evidencia de haber sido infectados por el SARS-CoV-2. 19.630 voluntarios recibieron la vacuna y 19.691 recibieron un placebo salino.
En general, la vacuna presentó una efectividad del 67% para prevenir la ocurrencia moderada a severa/crítica del Covid-19 en por lo menos los primeros 14 días tras la vacunación y 66% de efectividad en la prevención de una expresión moderada a severa/crítica del Covid-19 en por lo menos los primeros 28 días tras la vacunación.
Adicionalmente, la vacuna presentó una efectividad del 77% para prevenir la ocurrencia severa/crítica del Covid-19 en por lo menos los primeros 14 días tras la vacunación y un 85% efectiva en prevenir un Covid-19 severo/crítico tras por lo menos 28 días después de la vacunación.
14 días o después de haber recibido la vacuna, hubieron 116 casos de Covid-19 en el grupo de voluntarios que recibió la vacuna, lo que se compara con 348 casos de Covid-19 entre los voluntarios que recibieron el placebo.
28 días o después de la vacunación, hubieron 66 casos de Covid-19 entre los que recibieron la vacuna y 193 casos entre los que recibieron el placebo.
A partir del día 14 tras la vacunación hubieron 14 casos severos/críticos en el grupo de vacunados, lo que se compara con 60 casos severos/críticos de Covid-19 en el grupo que recibieron el placebo. Empezando el día 28 tras la vacunación, hubieron cinco casos severos/críticos de Covid-19 y 34 casos en el grupo del placebo.
La FDA resalta que a la fecha no existen datos disponibles para determinar el tiempo de protección que ofrece la vacuna de Johnson & Johnson. Tampoco hay evidencia para determinar si los vacunados no transmiten el SARS-CoV-2.
Copyright @ maquina-de-combate.com