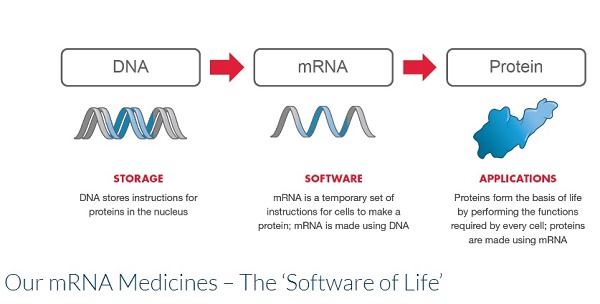
Moderna obtiene resultados positivos en la Fase 1 de ensayos clínicos de su vacuna candidato contra el Covid-19
mRNA-1273
maquina-de-combate.com – El laboratorio Moderna ha anunciado el día de hoy, 14 de julio de 2020, que su vacuna candidato mRNA-1273 contra el nuevo coronavirus ha inducida una rápida y fuerte respuesta inmune en los voluntarios que han participado en la Fase 1 de ensayos clínicos.
Los resultados del análisis interino de la Fase 1 del ensayo clínico con la vacuna candidato mRNA-1273 han sido publicados en el The New England Journal of Medicine. En el análisis se han evaluado los resultados de la administración de dos dosis del producto, con una separación de 28 días entre cada dosis y en tres niveles de dósis (25 µg, 100 µg y 250 µg) en 45 voluntarios adultos con edades que fluctúan entre los 18 y 55 años, con reportes al día 57 del ensayo clínico Fase 1.
Según Moderna, los resultados de los voluntarios que recibieron ambas dosis iniciales confirman los datos obtenidos el 18 de mayo pasado y muestran que la mRNA-1273 induce una rápida y fuerte respuesta inmune contra el SARS-CoV-2. El estudio ha sido liderado por especialistas del NIAID (National Institute of Allergy and Infectious Diseases), entidad adscrita al NIH (National Institutes of Health) de Estados Unidos.
La vacuna candidato mRNA-1273 han sido generalmente segura y bien tolerada, sin ningún evento adverso serio reportado al día 57. Los eventos adversos fueron generalmente pasajeros y ligeros a moderados. Los más notables eventos adversos fueron observados en el nivel de dosis 250 µg, con tres de los 14 voluntarios (21%) reportando uno o más eventos severos.
Los eventos adversos fueron más comunes luego de la segunda dosis en 13 de 54 voluntarios del grupo al que se le administraron dosis de 25 µg, en todos los 15 voluntarios del grupo de dosis de 100 µg y en todos los 14 voluntarios del grupo de 250 µg. Los eventos adversos más comunes reportados tras la segunda dosis en el grupo de 100 µg fueron fatiga (80%), escalofríos (80%), dolor de cabeza (60%) y dolor muscular (53%), todos los cuales fueron pasajeros y entre ligeros o moderados en severidad.
El evento adverso más común en el grupo de dosis de 100 µg fue dolor en el sitio donde se les administraron las inyecciones (100%).
La evaluación de los niveles de seguridad clínica y la no observación de eventos adversos inesperados revelaron que al momento no hay patrones preocupantes.
La mRNA-1273 indujo la generación de anticuerpos vinculantes a la cadena completa de la proteína Pico (Proteína S) del SARS-CoV-2 en todos los voluntarios tras la administración de la primera dosis. Todos los voluntarios mostraron anticuerpos hacia el día 15. El incremento de anticuerpos fue observado en los tres niveles de dosis, en función a la cantidad administrada de la vacuna candidato, y la cantidad incrementó tas la administración de la segunda dosis.
Luego de recibir las dos dosis, al día 57, la cantidad y diversidad de anticuerpos excedían aquellas vistas en 38 personas convalescientes de casos confirmados del Covid-19, de los cuales, un 15% fueron clasificados como casos con síntomas severos (hospitalización en cuidados intensivos y/o requiriendo ventilación mecánica), 22% clasificados como síntomáticos moderados y 63% como sintomáticos ligeros.
La actividad neutralizante fue evaluada con cultivos vivos del SARS-COV-2 y un pseudovirus (a manera de control). Ninguno de los voluntarios presentaban actividad neutralizante antes de recibir las dosis.
Tras las dos dosis del mRNA-1273, revela Moderna, se generó una robusta respuesta neutralizante de los anticuerpos generados. Al día 43, la actividad neutralizante contra el SARS-CoV-2 fue observada en todos los voluntarios. En el grupo de dosis de 100 µg, los niveles de anticuerpos eran 4.1 veces mayor que los de las personas convalescientes.
Se ha observado un notable incremento en la generación de anticuerpos en los voluntarios que recibieron dosis de 100 µg en relación a aquellos que recibieron 25 µg. En cambio el incremento de la respuesta inmune en los voluntario que recibieron 250 µg fue mínimo en relación a la dosis de 100 µg.
Los investigadores han seleccionado la dosis de 100 µg como la mejor opción para la Fase 3 del ensayo clínico para la mRNA-1273.
La evaluación de la durabilidad de la respuesta inmune está aún en curso.
Moderna a iniciado otro estudio de Fase 1 con 75 voluntarios con edades de 18 á 55 (15 personas), 56 á 70 (30 personas) y 71 a más (30 personas), con los tres mismos niveles diferenciados de dosis en cada rango de edades. El objetivo es obtener datos de la efectividad de la mRNA-1273 en personas de mayor edad.
Moderna ya ha enrolado los voluntarios para la Fase 2 de ensayos clínicos. 300 voluntarios con edades entre 18 y 55 años. Se administrarán dos dosis con una separación de 28 días entre cada dosis. Esta Fase incluye un grupo al que se le administrará un placebo. Cada voluntario recibirá un placebo, 50 µg o 100 µg del producto en ambas ocasiones.
El protocolo de la Fase 3 ya ha sido revisado por la FDA (Food and Drug Administration) y la compañía espera empezar la Fase 3 el 27 de julio, este mismo mes, con 3000 voluntarios que recibirán 100 µg de la mRNA-1273 o un placebo de manera aleatoria.
Los investigadores le apuntan a una eficacia aproximada del 60%. Se espera lograr en primer lugar que la infección del SARS-CoV-2 se a asintomática, en segundo lugar se busca prevenir síntomas severos del Covid-19 o prevenir la infección por SARS-CoV-2.
Fuente:
Moderna Announces Publication in The New England Journal of Medicine of Interim Results From Phase 1 Study of Its mRNA Vaccine Against COVID-19 (mRNA-1273) – July 14, 2020 at 5:14 PM EDT
https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-publication-new-england-journal-medicine